医疗器械系统工程最佳实践——MPI核心课程
浏览次数: 次
【课程概要】
企业发展到一定规模,必然要划分出职能部门和进行专业分工。但是各职能部门人员往往更专注于各自专业领域,如软件、硬件、机械、电气等,互相之间交流和协作很少,协调配合就成为了突出问题,例如:
1)用户需求分析能力差,对产品应用场景缺乏了解,不知道从几个维度去分析客户需求,不知道客户需求的本质,不会识别真需求还是少数人需求,用户需求太粗。
2)把用户需求转化为设计输入时,只考虑了功能性需求,前期缺少客服和生产等部门的参与,需求不完整。
3)设计方案思路不开阔,例如以竞品为样板,开发思路僵化,调试空间狭窄,供应商筛选苛刻,或为了差异化而差异化,导致后期产品适应性差,难以形成真正的产品优势。
4)缺乏高效评审的机制和能力,没有对研发过程进行管控,评审效果不佳。
5)设计转换不畅,导致转产周期太长。
6)产品注册的范围及其对多地域法规的合规性缺少通盘考虑,对项目进度和资源利用率产生很大影响。
7)市场、研发、生产、销售、售后服务各部门对产品的理解不同,各部门思维不在一个频道,后期无法就产品确认达成一致,产品迟迟不能定型。
8)风险管理与设计控制两张皮,走过场,空耗资源且存在安全性设计不足的隐患。
9)大量后补文档,写文档不是做设计而是写回忆录,文档内容不够严谨详实,知识难以传承和共享,更改可追溯性差。
10)项目策划缺乏团队协同,经常陷入到“一个人的战斗”状态,武断拍板,深远返工。
11)缺乏货架管理,未能形成自己的产品平台并实施基于平台的产品开发。浪费大量资源从事原本不必要的新设计。
本课程阐述了如何从用户需求出发,基于医疗器械设计控制、风险管理、市场准入合规性要求,集成各类专业技术,开发出满足客户要求的医疗器械的系统工程。本课程既是迈瑞、东芝等著名大型医疗器械企业最佳实践经验的总结,也集成了本人通过对近二十年培训和咨询过的众多医疗器械企业的实证成果,其有效性获得了企业的高度评价。课程内容高效浓缩、行业特色鲜明接地气、极具可操作性。
【培训对象】
- 研发系统:研发负责人、项目经理、系统工程师、研发工程师、研发管理人员;
- 质量系统:质量负责人、法规工程师、QA、质量管理体系工程师;
- 工程系统:工程负责人,设计转换工程师;
- 制造系统:生产负责人、新产品导入工程师;
- 市场营销系统、采购系统负责人。
【培训收益】
- 理解质量观与系统工程
- 理解医疗器械行业的研发环境:质量管理体系要求、风险管理、市场准入要求
- 设计控制及其各个单元的内容和管控要点,包括——用户需求、设计输入、技术解决方案、设计输出、验证、确认、评审、更改控制
- 掌握将质量管理体系要求、风险管理、市场准入要求、设计控制以及各类专业技术集成起来实施系统工程的方法。
【课程结构图】
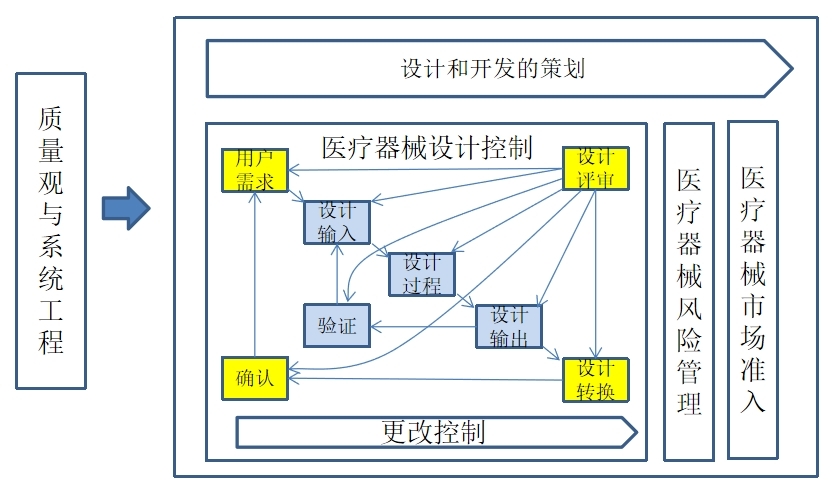
【课程大纲】(3天)
1.质量观与系统工程1.1.拨开质量的迷雾
- 什么是质量?
- 不同角色眼中的质量
- 研讨:质量画像。
- 质量目标与需求的关系
- 朱兰质量管理三步曲
- ISO的质量管理四部曲
- 戴明环
- 从范围上看
- 从层次上看
- 设计控制的组成
- 设计控制闭环
- 设计控制的作用
- 案例:设计控制与结构化流程的结合。
- 讨论:从QI角度看,您认为哪两个单元最关键?
- 市场准入法规
- 医疗器械质量管理体系
- 医疗器械风险管理
- 适用技术标准
- 设计控制、风险管理、市场准入及相互关系
- 系统工程与项目管理的关系。
2.设计控制
2.1.用户需求
- 如何解决前端的模糊性?
- 产品包、产品包需求
- 用户需求开发的典型场景
- 案例:产品包需求开发工具的应用
- 用户需求论证
- 项目可行性分析要点
- 用户需求分析的组织
2.2.设计输入
- 什么是设计输入
- 从粗旷开发到高质量开发
- 设计输入的管控要求
- 案例:用户需求&设计输入
- 用户需求向设计输入的转化
- 设计输入的分解模型
- QFD案例分享:吻合器、电动车
- 建立设计输入的总体结构
- 案例:某公司设计输入的结构
- 良好设计输入的准则
- 案例:产品需求规格说明书模板
- 管理需求更改
- 为技术状态项定义设计输入
- 风险分析
- 设计输入VS解决方案
- 游戏体验
- 有关设计输入的问题总结
2.3.设计过程
- 设计过程的分解与集成
- 系统方案设计关注要点:规定系统与子系统的体系结构、设计决策说明、产品树框图及技术状态项、系统如何满足需求能力的说明
- 案例:系统分析工具的应用
- 基于产品平台的产品开发:产品平台、共享技术要素
- 详细设计关注要点:各类DFX设计指南的建立及应用
2.4.设计输出
- 什么是设计输出:设计输出的定义、设计输出的层次
- 案例分析:《技术要求》是设计输入还是设计输出?
- 设计输出的完整性—四个面向
- 案例:设计输出不完整的表现和危害
- 产品集成过程:产品集成过程、接口更改控制
- 开发样件评审
- 设计输出的管控要求
2.5.设计转换
- 研发与生产的常见矛盾
- 案例:设计转换困惑的表现
- 什么是设计转换:设计转换的定义、基本目标、卓越目标
- 设计转化的认识是逐步提高的
- 设计转换的输入输出
- 设计转换的管控要点:DMR的控制、关注未经验证的过程、识别关键与特殊过程
- 案例:植入式螺钉的生产控制
- 设计转换的主要工程活动一览
- 工程样品评价的3-4-5模型:3个层级、4个方面、5个因素
2.6.设计验证与确认
- 验证与确认的概念:验证、测试、调试;确认
- 案例:验证与确认不良的问题
- 开发与验证、确认的并行工程:V模型、验证与确认的区别与联系
- 验证与确认团队活动的异同
- 验证的流程:验证的需求分析、验证的方案、验证的执行
- 产品验证方案模板
- 产品确认的内容
- 确认的流程:确认的需求分析、确认方案、产品确认报告
- 产品确认评审
- 案例分享:产品确认方案/报告模板
2.7.高效评审方法论
- 低效评审的表现与原因:低效的表现形式、思想原因、方法原因
- 评审的价值:某公司问题影响度统计、缺陷放大率、评审收益
- 评审管理的成熟度
- 高效评审方法论模型
- 高效评审的关键成功要素:评审策划、评审文化、评审团队、设计指南/准则、评审决策机制、评审流程与角色、评审测量分析、各种审查技术的合理使用、评审管理
2.8.更改的控制
- 更改控制所遵循的原则
- 技术状态文件:技术状态文件及其相关的概念、专用规范、通用规范
- 区分更改模式
- 导致更改的原因及前置分析
- 更改控制流程:设计更改、工程更改、工艺更改、临时更改、供应商的更改
- 案例分享:供应商更改控制
- 更改策略:问题解决的原则和顺序、更改及其验证范围、工作量估计、资源安排、日程安排
案例:更改列车捆绑的六个原则
3.医疗器械风险管理
3.1.医疗器械风险管理有关术语和定义
3.2.产品风险管理通用要求
- 风险管理过程
- 管理职责
- 人员资格
- 风险管理文档
- 医疗器械设计控制文档输出清单
- 风险管理计划
3.3.风险分析
- 风险分析过程
- 医疗器械预期用途和与安全性有关特征的判定
- 危害的判定
- 估计每种危害状况的风险
- 案例:产品风险分析表
3.4.风险评价
- 风险评价原则:确定风险可接受性的方法、考虑当前技术发展水平以及可用的信息、评估因采取风险控制措施而产生的新风险、考虑受益者对风险的感知
- 风险评价准则:概率的评价、严重度的评价
- 案例分享:风险评价准则
3.5.风险控制
- 风险控制方案:风险控制方案的三原则三顺序、产品平台的风险控制、产品开发过程的风险控制
- 风险控制方案的实施
- “低至合理可行”的风险控制
- 编写风险告知信息
- 案例:风险控制措施
- 风险控制有效性验证
- 风险-受益比较
- 全部剩余风险评价
3.6.风险管理报告
- 案例分享:风险管理报告
3.7.生产和生产后信息:用于对产品操作者、使用者,或对产品安装、使用和维护负责的人提供的信息进行收集的机制、新的或修订的标准、收集和评审市场上的相似产品的公认的信息
3.8.风险管理与FMEA
4.设计和开发的策划
4.1.设计和开发策划的意义
4.2.研发管理体系的策划
- 技术流程
- 管理流程
4.3.产品开发生命周期的定制:一次性完成式、增量式、演进式
4.4.设计和开发策划的时机和类型
- 产品规划
- 立项策划
- 项目综合开发计划
- 更改的策划
4.5.项目核心小组法
- 项目组组建流程
- 项目核心小组的组成:项目经理、系统工程师、职能代表、QA的角色与职责。
4.6.系统工程师的职业发展
- 系统工程师岗位价值及其定位
- 系统工程师的职责
- 系统工程师的技术发展通道
- 系统工程师的培养和职业发展之路
5.课程总结

