医疗器械研发质量管理最佳实践
浏览次数: 次
【课程概要】
医疗器械质量管理体系及其相关的设计控制,是医疗器械上市准入审查的关注焦点。医疗器械企业常常在产品开发出来后因不能满足质量管理体系的考核要求,花大量时间整改,延误上市时间,常常造成巨大损失。医疗器械企业面临着如何在满足质量管理体系要求的前期下实现高效地产品开发的挑战。
本课程是医疗器械设计开发最佳实践经验的总结。从医疗器械制造商角度,简明、完整地阐述了医疗器械设计控制及其风险管理模型,为医疗器械企业提供以客户为关注焦点、满足医疗器械合规性要求、实现企业运营目标的医疗器械设计开发模型。
【培训对象】
- 研发系统:研发负责人及研发工程师、研发管理人员;
- 质量系统:质量负责人、法规工程师、QA、质量管理体系工程师;
- 工程系统:工程负责人,设计转换工程师;
- 制造系统:生产负责人、新产品导入工程师;
- 市场营销系统、采购系统负责人。
【培训收益】
- 理解质量观
- 理解医疗器械研发的法规环境
- 掌握医疗器械研发质量管理的核心要求—设计控制闭环
- 理解医疗器械研发过程输出的文档要求
- 理解医疗器械风险分析的要求
- 掌握医疗器械风险分析如何在研发中贯彻
- 理解研发质量策划、质量保证、质量控制、质量改进的过程
- 掌握七大质量管理原则
【课程结构图】
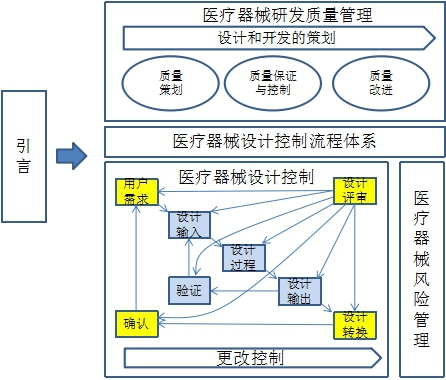
【课程大纲】(3天)
1.引言
- 讨论:什么是质量?研发质量管理的目的是什么?
1.1.拨开质量的迷雾
1.2.质量观决定质量管理的理念
1.3.质量保证VS质量控制VS质量改进
1.4.质量管理与质量管理流程
- 什么是质量管理?
- 朱兰三步曲
- ISO四步曲
- 戴明环
1.5.医疗器械设计开发的合规性要求
- 市场准入法规
- 医疗器械质量管理体系
- 医疗器械风险管理
- 适用技术标准
1.6.什么是设计控制闭环
- 讨论:从QI角度看,您认为哪两个单元最关键?
- 案例分享:设计控制与结构化流程的结合
1.7.什么是研发质量管理?
1.8.研发质量管理的框架
2.设计控制闭环
2.1.用户需求与设计输入
- 用户需求VS设计输入
- 设计输入的管理要求
- 如何解决前端的模糊性?
- 用户需求分级的意义
- 用户需求向设计输入的转换
- QFD案例分享:吻合器、电动车
- 识别设计输入的载体
- 讨论:本公司的哪些文件属于设计输入?
- 设计输入的分解模型
- 良好设计输入的标准
- 为技术状态项定义设计输入
- 风险分析(FMEA)
- 设计输入VS解决方案
- 有关设计输入的问题总结
2.2.设计过程
- 设计方案与设计输入的关系
- 总体方案关注的要点
- 详细设计关注的要点
2.3.产品集成
- 确定产品集成顺序
- 建立产品集成环境
- 建立集成程序和准则
- 审查接口
- 管理接口
- 组件准备就绪
- 集成产品组件
- 评估已集成的产品组件
2.4.设计输出
- 案例:设计输出不完整的危害
- 项目完整输出的包括的范围
- 设计输出在管理上的要求
2.5.设计转换
- 案例:设计转换问题分析
- 设计转换的疑惑
- 研发与生产的矛盾
- 认识逐步提高的过程
- 明确设计转换的目的
- 设计转换的输入和输出
- 设计转换的关注要点
2.6.设计验证与确认
- 验证与确认的联系与区别
- 验证与确认的管理要求
- 验证与确认的关注要点
- 案例分享:产品确认与验证的策划
- 产品确认的内涵
2.7.高效评审方法论
- 高效评审体系概述
讨论:评审的目的是什么?
- 高效评审的计划
- 高效评审文化
- 高效评审团队
- 产品平台对高效评审的支持
- 决策机制
- 正规评审流程
- 高效评审的管理
2.8.更改的控制
- 更改控制所遵循的原则
- 技术状态文件—六大专用规范
- 区分更改模式
- 设计更改
- 工程更改
- 工艺更改
- 临时更改
- 供应商的更改
- 案例分享:供应商更改控制
3.医疗器械风险管理
3.1.医疗器械风险管理有关术语和定义
3.2.产品风险管理通用要求
- 风险管理过程
- 管理职责
- 人员资格
- 风险管理文档
- 医疗器械设计控制文档输出清单
3.3.风险分析
- 风险分析过程
- 产品风险有关的特征的判定
- 危害的判定
- 估计每种危害状况的风险
3.4.风险评价
- 风险评价准则
- 概率的评价
- 严重度的评价
- 案例分享:风险评价准则
3.5.风险控制
- 降低风险
- 风险控制方案分析
- 风险控制措施的实施
- 剩余风险的评价
- 风险/受益分析
- 风险控制的三原则和三顺序
- 风险控制措施引起的风险
- 风险控制的完整性
- 全部剩余风险的可接受性评价
3.6.风险管理报告
3.7.生产和生产后信息
- 用于对产品操作者、使用者,或对产品安装、使用和维护负责的人提供的信息进行收集的机制
- 新的或修订的标准
- 收集和评审市场上的相似产品的公认的信息
3.8.风险管理与设计控制的结合
- 案例分享:风险管理报告
4.研发质量管理
4.1.研发质量策划
- 五大过程、十大知识领域
- 项目级策划与组织级策划
- 案例分享:医疗器械设计控制流程体系模型
- 编制项目计划
- 编制项目计划的原则
- 案例分享:基于设计控制体系的项目计划
4.2.项目质量保证与控制
- 质量保证与质量控制的两个层次
- 质量保证与质量控制的手段
- QA工作计划模板
4.3.项目质量改进
- 产品改进与过程改进
- 研发质量问题收集与处理
- 质量目标的分析与确定
- 纠正预防措施(CAPA)
- 案例分享:分层FRACAS
- 改进成熟度的阶段模型
- 改进前后一些重要度量数据的比较
- 七大质量管理原则
5.课程总结
本培训课程可根据客户需要,课时和内容均可调整,如有需要,请联系我们!
学习方式:案例分享、实务分析、互动讨论、项目模拟
报名咨询:0755-26070628, 18038064508,微信:18998939039
本课程可为企业提供内训,欢迎来电咨询!
【回复电邮】 1813019654@qq.com

